Sååå här kommer ett nytt ämne – tentafrågor. Det här är riktiga frågor som vi själva har haft vilket jag tror kan va nyttigt att gå igenom =) I och med att vi kör pbl (problem baserat lärande) stilen så är fallen konstruerade som om de vore riktiga patienter och därför får man inte bläddra fram och tillbaks på provet (man kan ju inte gå tillbaks i tiden i verkligheten eller hur?) Därför kommer du att se att svaren på frågorna ibland kommer att dyka upp vid fortsättningen av fallet.. Good luck
Tenta 1
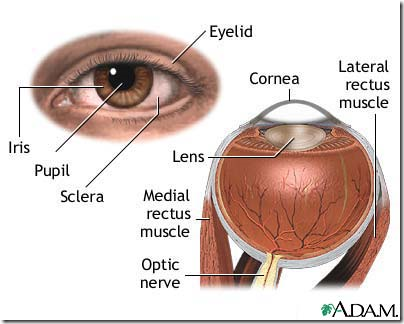
Axel, 23 år, kommer till ögonmottagningen eftersom han tycker att han sedan i går ser suddigt
på höger öga. Axel har tidigare varit frisk.
Status: Kraftigt nedsatt synskärpa på höger öga, medan det vänstra ögats synskärpa är normal.
Axel har också ett bortfall centralt i det högra ögats synfält. Det högra ögats syn och synfält är
normalt.
Fråga A1 (3p)
Var är skadan belägen, det vill säga vilka strukturer kan tänkas vara drabbade i samband med
Axels synnedsättning? Ange två principiella tänkbara orsaker (principiella mekanismer).
Svarsförslag: Man kan tänka sig fel i ögats näthinna såsom näthinneavlossning, ischemisk
skada (centralvenstrombos) eller annat fel i synnerven och gangliecellerna såsom tumör eller
inflammation. I undantagsfall kan även synnervskorsningen vara drabbad, då med övervikt
för den ena synnerven. Skador längre bak i synbanorna leder inte till synnedsättning på ett
öga utan ger i stället liksidiga synfältsdefekter
Fortsättning av fallet
Man kan tänka sig fel i ögats näthinna såsom näthinneavlossning, ischemisk skada
(centralvenstrombos) eller annat fel i synnerven och gangliecellerna såsom tumör eller
inflammation.
Det görs en undersökning med s.k. VEP (Visually Evoked Potentials). Vid den
undersökningen får Axel titta på ett växlande svart-vitt rutmönster och man registrerar
signalen över synbarken. Resultatet är att Axel har en nedsatt nervledningshastighet (förlängd
latens) på höger sida, dvs. det tar längre tid för synsignalerna att färdas från ögat till
synbarken på höger sida än på vänster.
Fråga A2 (3p)
Beskriv denna signals normala väg från synnerven till synbarken!
Svar: Synnerv(gangliecell) –> chiasma –> Tractus otpicus—> Corpus geniculatum
laterale(synaps) –> Radiatio optica—> Synbarken(synaps).
Fortsättning av fallet
Synsignalen går via synnerven (gangliecell) till chiasma och vidare via tractus opticus, corpus
geniculatum laterale(synaps) och radiatio optica till synbarken(synaps).
Fråga A3 (2p)
Vid VEP-undersökningen placerar man en av elektroderna 2 cm ovanför inion (nackknölen).
Vilka områden (areor) i hjärnbarken kan man då tänka sig tänka att man registrerar ifrån i så
fall?
Svar: Area 17 (area striata, primära syncortex), area 18 och 19 (högre centra).
Fortsättning av fallet
Man konstaterar att Daniel har en optikusneurit (inflammation i synnerven) som leder till en
nedsatt nervledningshastighet. Normalt är neuronen är uppbyggda på ett sinnrikt sätt så att
impulsutbredningen i axonen sker mycket snabbt.
Fråga A4 (4p)
Förklara de bakomliggande mekanismerna till den normalt snabba fortledningen av impulser i
axonen. Ange också en tänkbar mekanism bakom den nedsatta nervledningshastigheten hos
Axel.
Svar: Myelinisering av nervens axon ökar hastigheten med vilken impulsen överförs. Gliacellen
som producerar denna myelinskida är oligodendrocyten i centrala nervsystemet och
Schwanncellen i det perifera nervsystemet. Myelinskidan kan innehålla upp till 300
membranlager och utgöra 20-40% av axonets diameter. De mycket små ”nakna” mellanrummen
på axonet mellan dessa myelinskidor kallas Ranvier´s node (knut). Myeliniseringen
tillåter att impulsen ”hoppar” från en knut till nästa istället för att utbredningen sker längs
hela axonet och detta medför mycket ökad impulsutbredning via s.k. ”saltatory conduction” .
Optikusneurit är ofta ett symtom på multipel skleros (MS). Denna sjukdom innebär en
demyelinisering som därför leder till nedsatt nervledningshastighet
Fortsättning av fallet
När man belyser Axels högeröga reagerar pupillen trögt (s.k. amblyopisk pupillreaktion), men
när man belyser det vänstra ögat reagerar bägge pupillerna normalt.
Fråga A5 (3p)
Förklara varför Axels högra pupill drar ihop sig när man belyser det vänstra!
Svar: Efter att ljuset träffat retina och omvandlats till elektrisk signal färdas denna signal
bakåt i synerven och tractus opticus till corpus geniculatum laterale. Där avviker pupillfibrerna
från synfibrernaoch går till nucleus pretectalis. Därifrån kopplas signalen till
Edinger-Westphals kärna på bägge sidor och från dessa kärnor till ganglion ciliare och
pupillerna i bägge ögonen.
Fortsättning av fallet
Axel upplever att djupseendet och samsynen är förändrade. Om man svänger en pendel framför
honom från höger till vänster uppfattar han pendelns rörelser som elliptiska dvs. som om
pendeln även rörde sig mot och från honom.
Fråga A6 (4p)
Beskriv hur samsynen fungerade när Axel var frisk!
Svar: Samma (korresponderande) delar av synfältet hamnar i samma neuron i synbarken.
Detta neuron kan mottaga information från bägge ögonen. För att detta ska fungera krävs
icke korsande och korsande fibrer i chiasma. Det högra synfältet hamnar i vänster hjärnhalva
och tvärtom. C:a 80% av neuronen i synbarken kan motta impulser från bägge ögonen. Om
signalen från det ena ögat, som i Axels fall, är fördröjd, kommer det ena ögats signal
representera en bild som ligger mer förskjuten åt sidan. Detta kan hjärnan endast tolka som
en rörelse i djupled.
Fortsättning av fallet
Man prövar färgsinnet genom att Axel får titta i böcker med siffror i olika färger. Axel har
inte en siffra rätt på höger öga men alla rätt på vänster.
Fråga A7 (4p)
Förklara hur färgsinnet fungerar på Axels vänstra, normala öga.
Svar: I retina finns 3 olika sorters tappar med pigment känsligt för blått, grönt och rött.
Tapparna är alltså känsliga för olika våglängder enligt följande figur.
Alla färger vi upplever utgörs av en kombination av signalerna från dessa fotoreceptorer. När
det gäller gangliecellerna föreligger ett färgopponentsystem där de opponerande färgerna är
blå-gul respektive röd-grön.
Tenta 2
Fråga B5 (4p) Varför har Anders svårt att skilja rött och grönt från varandra trots att han bara saknar en typ av tappar? Beskriv också vilka färger ögat är känsligt för och ungefär hur dessa färger är fördelade i spektrum?
Svar:
Anders har svårt att se även röda föremål eftersom känsligheten i det röd-gröna området utgörs av summan av de bägge receptorernas känslighet. En rubbning av den ena påverkar markant denna samverkan mellan rött och grönt. Blått Rött Våglängd Känslighet Rött Grönt Blått
Fråga B6 (4p) Redogör för ögats olika mekanismer att anpassa sig till mörkerseende och ange ungefär hur snabbt dessa har effekt och hur stor relativ effekt de har!
Svar:
Pupillen: Relativt liten effekt. Reagerar på någon sekund.
Neuronal adaptation: Framför allt en minskad inhibition från amacrincellerna. Tar någon till några sekunder. Har större effekt än pupillreaktionen.
Fotokemisk adaptation: Stavarna producerar mer rhodopsin vilket gör dem känsligare för ljus. Tar 30 - 45 min. Har mycket stor effekt och kan öka ljuskänsligheten 105 gånger.
Fråga B7 (2p) I det relativa mörker som råder märker Anders att det går att titta på ett föremål om man tittar strax bredvid (excentrisk fixation). Förklara detta fenomen.
Svar: Centralt i retina finns huvudsakligen tappar och dessa fungerar inte i denna belysning. Så fort man kommer utanför maculaområdet ökar dock tätheten av stavar gradvis och de fungerar i denna dämpade belysning.
Fråga B8 (3p)
Redogör för stavarnas elektriska koppling i retina?
Svar:
Flera stavar är kopplade till en bipolarcell. Bipolarcellen kopplar vidare till amacrinceller som kopplar på tapparnas signalsystem dvs. tapparnas bipolarceller och så vidare till tapparnas ganglieceller. Tapparna reagerar inte i denna belysning.
Tenta 3
Fråga B1 (4p)
Beskriv hur pupillens ljusreaktion fungerar!
Svar: Ljus faller på retina n. opticustractus opticusNucleus pretectalisEding-Westphals kärna (N III) bilateraltganglion ciliarepupillen
Fråga B2 (2p)
Beskriv iris olika muskelskikt och vilken påverkan de har på pupillen!
Svar: M. sphincter pupillae. Ringmuskel. Drar ihop pupillen. M. dilatator pupillae. Radiära muskelfibrer. Vidgar pupillen.
Fråga B3 (2p)
Ange vilka nervsystem som reglerar pupillens storlek och vilka muskler dessa nerver försörjer.
Svar: Det parasympatiska nervsystemet styr m . sphincter pupillae, fibrer i n. oculomotorius. Det sympatiska nervsystemet styr m. dilatator pupillae.
Fråga B4 (2p)
Vilken blir effekten av stimulering respektive blockering av sympatikus respektive parasympatikus avseende pupillens storlek? Vilket system har störst betydelse?
Svar: En blockering av parasympatikus vidgar pupillen, stimulering drar ihop. En blockering av sympatikus drar ihop pupillen, stimulering vidgar. Det parasympatiska nervsystemet har störst betydelse.
Bertil har nu alltså en vidgad, ljusstel pupill på hö öga.
Fråga B5 (2p)
Förklara hur den ljusstela pupillen har uppkommit i Bertils fall och ange också trolig orsak!
Svar:
Tenta 4
Fråga A1(3p)
Vilka strukturer är avgörande ögats ljusbrytning och vilken av dem har störst betydelse?
Svar: Hornhinnan och linsen. Hornhinnan har störst betydelse (43D) och linsen lite mindre (17D)
Fråga A2(4p)
Beskriv mekanismen som gör att vi kan se skarpt både på långt och nära håll och vad det är som styr denna mekanism.
Svar: Ackommodationen. Denna styrs av parasympatikus genom okulomotoriusnerven. Linsen är upphängd genom trådar i corpus ciliare, som är en ringmuskel. När denna muskel spänns slappnar trådarna av och linsen antar en mera klotrund form och får en ökad brytning, vilket ger ett bra seende på nära håll.
Fortsättning av fallet:
Av Arnes tidigare journal framgår att man vid 15 års ålder upptäckte en ordentlig astigmatism på höger öga. Hans astigmatism innebär att han ser vertikala linjer relativt skarpt och horisontella linjer suddigt. Det blir något bättre, men inte alls bra när han sätter på sig glas-ögonen.
Fråga A3 (4p)
Vad är orsaken till att synen inte förbättras helt med glasögon?
Svar: Arne har amblyopi på höger öga och borde ha korrigerats för detta i tidig ålder. Man kallar detta för meridional amblyopi, vilket innebär att celler i synbarken som är känsliga för horisontella linjer har understimulerats och atrofierat. Vid 15 års ålder finns ingen möjlighet att aktivera dessa igen.
Fråga A4(3p)
Hur får hornhinnan sin näringsförsörjning då det normalt sett inte finns några blodkärl i den?
Svar: Hornhinnan får sin näring från kammarvätskan, som produceras i corpus ciliare.
Fråga A6 (5p)
Redogör histologiskt för ögats vägg. ”Följ hela ögat runt” och påvisa eventuella skillnader.
Svar: Framtill, cornea: (epitel, Bowman´s lager, stroma, Descemet´s membran, endotel), sclera, shoroidea: (vaskulärt skikt, Bruch´s membran), retina: (pigment epitel, tappar och stavar, yttre nukleära lagret, yttre plexiforma lagret, inre nukleära lagret, inre plexiforma lagret, gangliecellslagret).
Tenta 5
Fråga 11 (9 p)
Evert 77 år, insjuknar plötsligt med svaghet i höger arm och ben. Söker
akutmottagningen och inlägges på neurologiska kliniken. Svagheten blir ganska snart
betydligt förbättrad. Karl-Erik märker vissa svårigheter att läsa. Han har svårt att se åt
höger.
a) Skador på synbanorna kan ha olika utseende beroende på var de sitter. Med
ledning av vad du vet om synfältet och synbanorna rita in de olika
synfältsdefekterna för motsvarande skadelokalisation (x) i cirklarna nedan.
Rita också in var du tror att Everts skada sitter. (6 p)
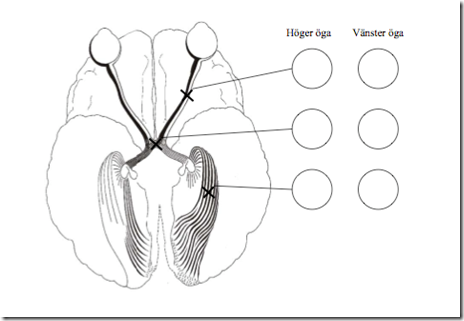
Everts synskärpa är fortfarande 1,0 på bägge ögonen vilket innebär att makulaområdet
är relativt välbevarat.
b) Beskriv makulas representation i synbarken! (3 p)
Svar:
a) Åkes defekt sitter i synstrålningen (radiatio optica).
b) Makula som utgör en relativt liten del av synfältet har en stor representation i synbarken.
Detta beror framför allt på att ett neuron i synbarken är kopplad till ett fåtal receptorer i retina.
Detta ger en hög upplösning.
Fråga 7 (5 p)
Beskriv anatomiskt och funktionellt den nervösa kontrollen av pupillen! (5 p
Svar: Pupillen styrs av sympatiska och parasympatiska trådar. De parasympatiska
trådarna drar ihop pupillen och en hämning av dessa vidgar pupillen. ??ögondroppen
hämmar det parasympatiska systemet. De parasympatiska trådarna utgår från
Edinger-Westphals del av oculomotoriuskärnan och löper tillsammans med
n. oculomotorius till ganglion ciliare och vidare till m. sphincter pupillae. De
sympatiska trådarna vidgar pupillen och en hämning drar ihop pupillen. De
sympatiska trådarna går via via ryggmärgen till ganglion stellatum och ganglion
cervicale superior på halsen och vidare till ögat och m. dilatator pupillae.
Fråga 8 (7 p)
Beskriv den elektriska signalens direkta väg från fotoreceptor till gangliecell
och de speciella egenskaperna som gäller för varje nivå i denna kedja. (De
kemiska processerna, fotokemi, transmittorer etc. behöver inte beskrivas.)
(7 p)
Svar: Signalen går från fotoreceptorer till bipolarceller och vidare till ganglieceller.
Fotoreceptorn avger mest elektrisk signal och är depolariserad i mörker och skiljer
sig på så sätt från andra receptorer. Den blir hyperpolariserad i ljus. Bipolarerna finns
av två typer: on och off. Genom en signalinvertering i synapsen mellan fotoreceptor
och bipolar blir on-bipolaren depolariserad och ”slår på” i ljus. Off-bipolaren däremot
reagerar på samma sätt som fotoreceptorn och blir hyperpolariserad (”slår av”) i ljus.
Här sker inge signalinvertering. Fotoreceptorer och bipolarer har s.k. graderade
potentialer d.v.s. amplituden på signalen är proportionell mot (logaritmen på)
ljusstyrkan. Från och med gangliecellen däremot är signalen frekvensmodulerad med
aktionspotentialer. Här är alltså frekvensen proportionell mot ljusstyrkan.
Gangliecellen återspeglar aktiviteten i bipolaren och kommer därför också att finnas
av två typer, nämligen on och off. Det sker ingen invertering av signalen i
övergången mellan bipolar och gangliecell.
Tenta 6
Anna 78 år, lider av förhöjt blodtryck. Hon kommer på remiss till ögonkliniken för
undersökning av om det föreligger några ögonbottenförändringar. När ögonläkaren skall
undersöka synen visar det sig att Anna har glömt sina glasögon hemma. Hon har för sig att
hon är närsynt. Vid synprövningen provas olika glas för att undersöka ögonens brytning.
Fråga C1 (2p)
Vilka är ögats ljusbrytande medier och hur påverkar de brytningen?
Svar: Cirka 2/3 av brytningen sker i cornea där kurvaturen är det som ger brytningen. Den
resterande delen sker i ögats lins. Till skillnad från cornea kan brytningen i linsen ändras så
att man ser skarpt på olika avstånd, det som man kallar för ackommodation.
Ackommodationsförmågan är beroende av åldern.
Därefter får Anna pupillvidgande droppar. Man undersöker sedan ögonbotten med en
ögonspegel.
Fråga C2 (4p)
Beskriv den normala ögonbottens utseende och funktionen på de strukturer du ser! Rita gärna!
Svar: Papillen = blinda fläcken, synnervsutträdet. Macula = gula fläcken. Kärlbågarna uppåt
och nedåt med vener respektive artärer.
Anna ser sämre på höger öga och här ser du förändringar i gula fläcken.
Fråga C3 (3p)
I fovea är upplösningen hög. Vilka faktorer är avgörande för den höga upplösningen?
Svar: I fovea är tätheten av tappar hög. Här finns inte heller några blodkärl i retina som
skymmer och receptorerna är snedställda och bildar en grop. Det faktum att en gangliecell är
kopplad till ett fåtal receptorer och att det förhållandet följs hela vägen till synbarken så att
ett synbarksneuron är kopplat till en eller ett fåtal receptorer. Detta innebär att en relativt
stor mängd neuron i synbarken tar hand om synfältets centrala delar.
När man lyser in i ögat omvandlas ljuset till nervimpulser som förmedlas av bipolärceller och
ganglieceller.
Fråga C4 (3p)
Vad är det för skillnad mellan bipolärceller och ganglieceller när det gäller förmedlingen av
nervimpulser?
Svar: Bipolärcellerna har graderade potentialer, vilket innebär att amplituden på signalen är
proportionell mot (logaritmen på) ljusmängden. Detta fungerar bra på korta distanser och är
lämpligt där signalen behöver moduleras av andra celler t ex. horisontalceller och
amakrinceller. Gangliecellerna har aktionspotentialer där i stället frekvensen är
proportionell mot ljusmängden. Detta är lämpligt när signalen skall färdas längre sträckor,
därför att hastigheten blir högre.
Fråga C5 (4p) Anna tycker att hon med åldern fått lite sämre mörkerseende. Redogör för
ögats olika sätt att anpassa sig till mörkerseende! Ange också hur snabbt de olika
mekanismerna verkar och vilken relativ betydelse de har!
Svar:
Pupillen: Relativt liten effekt. Reagerar på någon sekund.
Neuronal adaptation: Framför allt en minskad inhibition från amacrincellerna. Tar någon till
några sekunder. Har större effekt än pupillreaktionen.
Fotokemisk adaptation: Stavarna producerar mer rhodopsin vilket gör dem känsligare för
ljus. Tar 30 - 45 min. Har mycket stor effekt och kan öka ljuskänsligheten 105 gånger.
Tenta 7
Asta får tilltagande skav och irritation i höger öga och remitteras därför till ögonkliniken.
Där finner man att synskärpan är nedsatt på höger öga och normal på vänster.
Höger öga står öppet. Pat kan inte ens vid knipning täcka hornhinnan med övre ögonlocket.
Ögat är rött, hornhinnan aningen disig med en del småsår i epitelet, särskilt nedåt. Hornhinne-
sensibiliteten är ua.
Vänster öga blekt, retningsfritt.
Fråga A10 (1p)
Det föreligger alltså en uttorkningseffekt på ögats hornhinna, men hornhinnans känslighet är
normal. Vilken nerv och nervgren bör således fungera normalt?
Svar:
Fortsättning av fallet:
Ögats uttorkning beror på dålig slutning av ögonlocken, men också på dålig tårproduktion.
Tårarna produceras i tårkörteln.
Fråga A11 (1p)
Rita eller beskriv var tårkörteln sitter.
Svar: